La réponse cellulaire à l’hypoxie est contrôlée par une famille de facteurs de transcription : hypoxia-inducible factors (HIFs).
HIF est un hétérodimère composé de deux sous-unités : HIFalpha et HIFalpha.
HIFalpha existe sous la forme de 3 isoformes (HIF1alpha, HIF2alpha et HIF3alpha) qui sont synthétisées de manière continue en réponse à l’hypoxie.
HIFs régulent la transcription du gène de l’EPO et donc la synthèse d’EPO qui est produite essentiellement par des cellules péritubulaires rénales. HIF2alpha est le principal isoforme régulant l’expression de l’EPO.
En situation de normoxie, HIFalpha est détruit rapidement par l’effet combiné de l’oxygène, d’enzymes à domaine prolyl hydroxylase (PHD) et la protéine VHL (Von Hippel-Lindau), suppresseur de tumeur. La forme hydroxylée de HIFalpha peut se fixer à VHL et le complexe HIFalpha-VHL facilite la dégradation de HIFalpha via le protéasome (Cf. Figure).
En situation d’hypoxie, la dégradation protéasomale de HIFalpha est ralentie entraînant son accumulation au niveau cytoplasmique, son passage au niveau nucléaire et sa dimérisation avec HIFalpha. Les deux molécules ensemble se lient à de courtes séquences d’ADN qui contiennent les éléments de réponse à l’hypoxie et qui régulent la transcription oxygéno-dépendante des gènes cibles de HIF. Les produits de ces gènes regroupent l’EPO, la transferrine, le récepteur à la transferrine ou encore le VEGF.
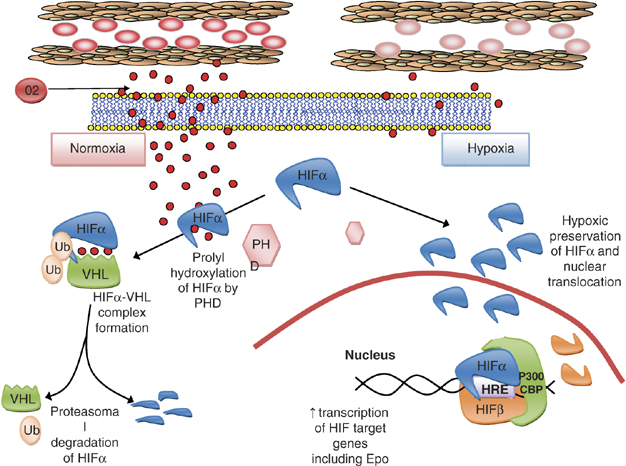 figure : Leukemia (2009) 23, 834–844; doi:10.1038/leu.2009.54; published online 19 March 2009
figure : Leukemia (2009) 23, 834–844; doi:10.1038/leu.2009.54; published online 19 March 2009
The complete evaluation of erythrocytosis: congenital and acquired
M M Patnaik1 and A Tefferi1
